QUÍMICA ORGÂNICA I
Isômeros são compostos que possuem a mesma fórmula molecular com estruturas diferentes. Dentro da isomeria, encontramos a isomeria geométrica, que pode ocorrer em compostos com ligação dupla entre carbonos (Alcenos) ou em compostos saturados cíclicos (Ciclanos). Considerando as informações dadas acima, qual dos compostos a seguir apresenta isomeria cis-trans:
2,3-dimetilbut-2-eno
1,2-dimetilciclobutano
1,1-dimetilciclobutano
But-1-eno
2-metilbut-2-eno
O fato de alcenos apresentarem uma ou mais ligações duplas torna a molécula bastante rígida, permitindo que exista a isomeria geométrica cis e trans. A denominação cis e trans é adequada para moléculas que apresentam apenas dois tipos de substituintes. Quando trabalhamos com moléculas trissubstituídas ou tetrassubstituídas devemos usar a denominação E-Z. Portanto, qual o nome do composto orgânico cuja fórmula encontra-se esquematizada a seguir?
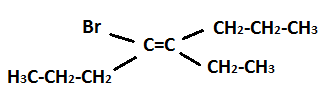
Cis-4-bromo-5-etiloct-4-eno.
E-4-bromo-5-etiloct-4-eno.
Z-4-bromo-5-etiloct-4-eno.
Z-4-etil-5-bromooct-4-eno.
Trans-4-bromo-5-etiloct-4-eno.
No ano de 1931, o físico alemão Erich Hückel realizou uma série de cálculos matemáticos sobre a estrutura do benzeno. A partir desses cálculos estabeleceu uma regra para a aromaticidade de compostos. A regra de Hückel é aplicada a compostos formados por um anel plano e que cada átomo possua um orbital p, tal como o benzeno.
Para generalizar a idéia de “aromaticidade” podese dizer que: possui caráter aromático todos os compostos cíclicos, de anéis planos que seguem a regra 4n +2 = nº elétrons p, se n for um número inteiro. Considerando as informações acima, assinale a alternativa que corresponde aos compostos não aromáticos dentre os abaixo:
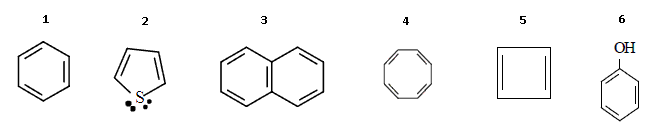
1, 3 e 6.
2 e 5.
2, 4 e 5.
4 e 5.
3 e 5.
É muito comum em Olimpíadas, copa do mundo de futebol, jogos do campeonato brasileiro, os atletas serem escolhidos para realizarem testes para verificar se estão sob efeito de drogas que potencializam seus desempenhos. Nas Olimpíadas de Beijing um halterofilista ucraniano, no teste de urina apresentou uma substância denominada nandrolona, um esteróide anabolizante. Esse esteróide é comercializado na forma decanoato de nandrolona, que sofre hidrólise, liberando a nandrolona no organismo. Sua fórmula estrutural está apresentada abaixo:
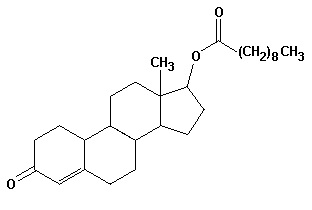 Na estrutura da nandrolona, identifique as funções orgânicas presentes:
Na estrutura da nandrolona, identifique as funções orgânicas presentes:
amida e fenol
apenas cetona
cetona e éster
éter e cetona
ácido carboxílico e aldeído
Dentre as funções oxigenadas presentes nos compostos orgânicos temos os aldeídos. São substâncias que possuem na sua estrutura o grupo aldoxila (-CHO). Vários aldeídos estão presentes no nosso dia a dia, como por exemplo, o metanal conhecido como aldeído fórmico. Sua solução aquosa contendo 40% de aldeído fórmico é conhecida como formol e é utilizada como solução antisséptica. Além disso, é usada na medicina como conservador de cadáveres e peças anatômicas. Abaixo está apresentado um aldeído de cadeia ramificada, que de acordo com a IUPAC, é denominado de:
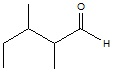
1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.
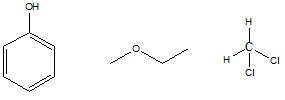
Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
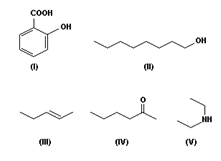 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.
2,3-dimetilbut-2-eno
1,2-dimetilciclobutano
1,1-dimetilciclobutano
But-1-eno
2-metilbut-2-eno
O fato de alcenos apresentarem uma ou mais ligações duplas torna a molécula bastante rígida, permitindo que exista a isomeria geométrica cis e trans. A denominação cis e trans é adequada para moléculas que apresentam apenas dois tipos de substituintes. Quando trabalhamos com moléculas trissubstituídas ou tetrassubstituídas devemos usar a denominação E-Z. Portanto, qual o nome do composto orgânico cuja fórmula encontra-se esquematizada a seguir?

Cis-4-bromo-5-etiloct-4-eno.
E-4-bromo-5-etiloct-4-eno.
Z-4-bromo-5-etiloct-4-eno.
Z-4-etil-5-bromooct-4-eno.
Trans-4-bromo-5-etiloct-4-eno.
No ano de 1931, o físico alemão Erich Hückel realizou uma série de cálculos matemáticos sobre a estrutura do benzeno. A partir desses cálculos estabeleceu uma regra para a aromaticidade de compostos. A regra de Hückel é aplicada a compostos formados por um anel plano e que cada átomo possua um orbital p, tal como o benzeno.
Para generalizar a idéia de “aromaticidade” podese dizer que: possui caráter aromático todos os compostos cíclicos, de anéis planos que seguem a regra 4n +2 = nº elétrons p, se n for um número inteiro. Considerando as informações acima, assinale a alternativa que corresponde aos compostos não aromáticos dentre os abaixo:

1, 3 e 6.
2 e 5.
2, 4 e 5.
4 e 5.
3 e 5.
É muito comum em Olimpíadas, copa do mundo de futebol, jogos do campeonato brasileiro, os atletas serem escolhidos para realizarem testes para verificar se estão sob efeito de drogas que potencializam seus desempenhos. Nas Olimpíadas de Beijing um halterofilista ucraniano, no teste de urina apresentou uma substância denominada nandrolona, um esteróide anabolizante. Esse esteróide é comercializado na forma decanoato de nandrolona, que sofre hidrólise, liberando a nandrolona no organismo. Sua fórmula estrutural está apresentada abaixo:
 Na estrutura da nandrolona, identifique as funções orgânicas presentes:
Na estrutura da nandrolona, identifique as funções orgânicas presentes:
amida e fenol
apenas cetona
cetona e éster
éter e cetona
ácido carboxílico e aldeído
Dentre as funções oxigenadas presentes nos compostos orgânicos temos os aldeídos. São substâncias que possuem na sua estrutura o grupo aldoxila (-CHO). Vários aldeídos estão presentes no nosso dia a dia, como por exemplo, o metanal conhecido como aldeído fórmico. Sua solução aquosa contendo 40% de aldeído fórmico é conhecida como formol e é utilizada como solução antisséptica. Além disso, é usada na medicina como conservador de cadáveres e peças anatômicas. Abaixo está apresentado um aldeído de cadeia ramificada, que de acordo com a IUPAC, é denominado de:

1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

Cis-4-bromo-5-etiloct-4-eno.
E-4-bromo-5-etiloct-4-eno.
Z-4-bromo-5-etiloct-4-eno.
Z-4-etil-5-bromooct-4-eno.
Trans-4-bromo-5-etiloct-4-eno.
No ano de 1931, o físico alemão Erich Hückel realizou uma série de cálculos matemáticos sobre a estrutura do benzeno. A partir desses cálculos estabeleceu uma regra para a aromaticidade de compostos. A regra de Hückel é aplicada a compostos formados por um anel plano e que cada átomo possua um orbital p, tal como o benzeno.
Para generalizar a idéia de “aromaticidade” podese dizer que: possui caráter aromático todos os compostos cíclicos, de anéis planos que seguem a regra 4n +2 = nº elétrons p, se n for um número inteiro. Considerando as informações acima, assinale a alternativa que corresponde aos compostos não aromáticos dentre os abaixo:

1, 3 e 6.
2 e 5.
2, 4 e 5.
4 e 5.
3 e 5.
É muito comum em Olimpíadas, copa do mundo de futebol, jogos do campeonato brasileiro, os atletas serem escolhidos para realizarem testes para verificar se estão sob efeito de drogas que potencializam seus desempenhos. Nas Olimpíadas de Beijing um halterofilista ucraniano, no teste de urina apresentou uma substância denominada nandrolona, um esteróide anabolizante. Esse esteróide é comercializado na forma decanoato de nandrolona, que sofre hidrólise, liberando a nandrolona no organismo. Sua fórmula estrutural está apresentada abaixo:
 Na estrutura da nandrolona, identifique as funções orgânicas presentes:
Na estrutura da nandrolona, identifique as funções orgânicas presentes:
amida e fenol
apenas cetona
cetona e éster
éter e cetona
ácido carboxílico e aldeído
Dentre as funções oxigenadas presentes nos compostos orgânicos temos os aldeídos. São substâncias que possuem na sua estrutura o grupo aldoxila (-CHO). Vários aldeídos estão presentes no nosso dia a dia, como por exemplo, o metanal conhecido como aldeído fórmico. Sua solução aquosa contendo 40% de aldeído fórmico é conhecida como formol e é utilizada como solução antisséptica. Além disso, é usada na medicina como conservador de cadáveres e peças anatômicas. Abaixo está apresentado um aldeído de cadeia ramificada, que de acordo com a IUPAC, é denominado de:

1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

1, 3 e 6.
2 e 5.
2, 4 e 5.
4 e 5.
3 e 5.
É muito comum em Olimpíadas, copa do mundo de futebol, jogos do campeonato brasileiro, os atletas serem escolhidos para realizarem testes para verificar se estão sob efeito de drogas que potencializam seus desempenhos. Nas Olimpíadas de Beijing um halterofilista ucraniano, no teste de urina apresentou uma substância denominada nandrolona, um esteróide anabolizante. Esse esteróide é comercializado na forma decanoato de nandrolona, que sofre hidrólise, liberando a nandrolona no organismo. Sua fórmula estrutural está apresentada abaixo:
 Na estrutura da nandrolona, identifique as funções orgânicas presentes:
Na estrutura da nandrolona, identifique as funções orgânicas presentes:
amida e fenol
apenas cetona
cetona e éster
éter e cetona
ácido carboxílico e aldeído
Dentre as funções oxigenadas presentes nos compostos orgânicos temos os aldeídos. São substâncias que possuem na sua estrutura o grupo aldoxila (-CHO). Vários aldeídos estão presentes no nosso dia a dia, como por exemplo, o metanal conhecido como aldeído fórmico. Sua solução aquosa contendo 40% de aldeído fórmico é conhecida como formol e é utilizada como solução antisséptica. Além disso, é usada na medicina como conservador de cadáveres e peças anatômicas. Abaixo está apresentado um aldeído de cadeia ramificada, que de acordo com a IUPAC, é denominado de:

1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

amida e fenol
apenas cetona
cetona e éster
éter e cetona
ácido carboxílico e aldeído
Dentre as funções oxigenadas presentes nos compostos orgânicos temos os aldeídos. São substâncias que possuem na sua estrutura o grupo aldoxila (-CHO). Vários aldeídos estão presentes no nosso dia a dia, como por exemplo, o metanal conhecido como aldeído fórmico. Sua solução aquosa contendo 40% de aldeído fórmico é conhecida como formol e é utilizada como solução antisséptica. Além disso, é usada na medicina como conservador de cadáveres e peças anatômicas. Abaixo está apresentado um aldeído de cadeia ramificada, que de acordo com a IUPAC, é denominado de:

1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

1,2-dimetilpentanal
2,3-dimetilpentanal
2,3,4-trimetilbutanal
2,3-dimetilbutanal
1,2,3-trimetilbutanal
A partir do gás natural, pode ser produzido alcenos de baixo peso molecular a partir do craqueamento térmico. O mesmo é utilizado como matéria-prima para polimerização além de serem importantes na produção de diversos compostos químicos, como por exemplo:
 A equação representada acima é classificada como uma reação de:
A equação representada acima é classificada como uma reação de:
Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

Condensação
Combustão
Substituição
Adição
Eliminação
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.
Diminui com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Abaixo estão apresentados três compostos orgânicos, um fenol, um éter e um composto clorado.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

Sobre as estruturas dessas substâncias, são feitas as seguintes afirmações:
I - o fenol é denominado hidroxibenzeno, o éter é denominado metóxi etano e o composto clorado é denominado diclorometano.
II - a função orgânica do composto clorado é haleto orgânico.
III - o éter apresenta um carbono secundário.
IV - o hidroxibenzeno apresenta três elétrons pi.
Analise as afirmações abaixo sobre as estruturas dos mesmos.
Apenas II e IV são verdadeiras.
Apenas I e III são verdadeiras.
Apenas III e IV são verdadeiras.
Apenas I e II são verdadeiras.
Apenas I são verdadeiras.
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida
Propriedades físicas como ponto de fusão e ponto de ebulição dependem fortemente do tipo de interação que ocorre entre as moléculas de uma determinada substância. Grande parte dos compostos orgânicos são covalentes, isso quer dizer que, basicamente as interações são de três tipos: dipolo-induzido, dipolo-dipolo (dipolo permanente) ou ligação de hidrogênio. Quanto maior a força da interação maior será os pontos de fusão e ebulição. Abaixo são apresentadas fórmulas estruturais de algumas substâncias orgânicas.
I- CH3CH2CHO II- CH3COOH III- CH3CH2CH2OH IV- CH3CH2CH2CH3
Após analisar os compostos acima, assinale a alternativa que os dispõe em ordem decrescente de pontos de ebulição.

ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-2-ona; dietilamina
ácido orto-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-2-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; pent-3-eno; hexan-5-ona; dietilamida
ácido para-hidroxibenzóico; octan-1-ol; pent-2-eno; hexan-5-ona; dietilamina
ácido orto-hidroxibenzóico; octan-2-ol; pent-2-eno; hexan-2-ona; dietilamida